Gázok moláris téfogata
Szükséges eszközök:
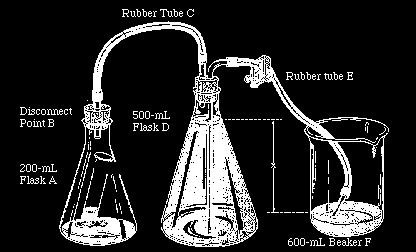
a képen látható berendezés

Kísérlet: Figyelem! A kísérlet végrehajtása fokozott óvatosságot igényel!!!
1. Elegyítsünk óvatosan 10 cm3 hidrogén-peroxid
és 25 cm3 kénsav oldatot, az elegyet öntsük
a 200 cm3-es Erlenmeyer lombik aljára.
2. Lyukas oldalfalú kémcsõ aljára szórjunk
0,79g kristályos kálium-permanganátot és helyezzük
óvatosan a savelegyet tartalmazó lombikba.
3. Helyezzük vissza a lombikba a dugót, majd óvatosan
döntsük meg annyira, hogy az anyagok reakcióba léphessenek.
Tapasztalat:
4. A fejlõdõ gáz vizet szorit ki az Erlenmeyer lombikból a fõzõpohárba.
Magyarázat
A reakció során oxigén gáz keletkezik a következõ egyenlet szerint:
2 MnO4- + 5 H2O2 + 6H+ = 2 Mn2+ + 8H2O +5 O2
A kiszorított víz térfogatának megmérése után az oxigén gáz moláris térfogata (az adott hõmérsékleten és nyomáson, a Dalton-törvényt figyelembe véve) kiszámolható. A fejlõdõ gáz mólszámát a kálium-permanganát mennyiségébõl számolhatjuk ki, mert a savakat feleslegben vettük.
A kísérletet
más gázokkal is elvégezve az Avogadro-törvény
is igazolható.