
Az 1998/99. tanévi
ORSZÁGOS KÖZÉPISKOLAI TANULMÁNYI VERSENY
első (iskolai) fordulójának
feladatmegoldásai
KÉMIÁBÓL

feladatmegoldásai
KÉMIÁBÓL
Az értékelés szempontjai
Egy-egy feladat összes pontszáma a részpontokból tevődik össze. Csak
hibátlan megoldásokért adható teljes pontszám. Részlegesen jó megoldásokat
a részpontok alapján kell pontozni.
Számítási - nem elvi - hiba esetén a feladat összpontszámából 1-2 pontot
le kell vonni.
A megadottól eltérő minden helyes megoldás elfogadható.
Elérhető pontszámok:
I. feladatsor: 20 pontTovábbküldhetők a legalább 50 pontot elért dolgozatok.
II. feladatsor: 80 pont
Összesen: 100 pont
MEGOLDÁSOK
I. feladatsor
| 1. | B | 6. | B | 11. | D | 16. | E |
| 2. | C | 7. | D | 12. | D | 17. | C |
| 3. | E | 8. | E | 13. | A | 18. | C |
| 4. | E | 9. | B | 14. | D | 19. | D |
| 5. | D | 10. | A | 15. | C | 20. | A |
Összesen: 20 pont
II. feladatsor
1. feladat
a) Anyagok: vízmentes CuSO4, pl. NaOH, H2 (3)
b) Cu2+ + 2 OH- => Cu(OH)2
világoskék csapadék
Cu(OH)2 => CuO + H2O
fekete por
CuO + H2 => Cu + H2O
vöröses fém (3)
Összesen: 6 pont
2. feladat
Ha cA és cB kezdeti koncentrációkból indulunk ki, akkor: v0 = kcAcB2
Háromszorosára növelve a nyomást a koncentrációk is háromszorosára növekednek, (1)
így: v1 = k3 cA (3 cB)2 = 27kcAcB2 = 27 v0.
A reakciósebesség 27-szeresére nő.
(2)
Összesen: 7 pont
3. feladat
a) Reakcióegyenlet:
CH3OH + Cr2O72- + 8 H+ => 2 Cr3+ + CO2 + 6 H2O (2)
b) A K2Cr2O7 anyagmennyisége:
n(K2Cr2O7) = cV = 2,50 mmol
A metil-alkohol anyagmennyisége:
n(CH3OH) = n(K2Cr2O7) = 2,50 mmol,
tömege:
m(CH3OH) = nM = 0,08 g.
A metil-alkohol-oldat töménysége:
c'= m / V = 0,08 g / 20,0.10-3
dm3 = 4,00 g/dm3 (4)
Összesen: 6 pont
4. feladat
Az elektromotoros erők:
1-es cella: 0,925 V;
2-es cella: 0,471 V. (2)
Az 1-es cella áramot termel, a másikban elektrolízis történik. (3)
Folyamatok:
1-es cella: 2 Ag3 + 2 e- = 2 Ag
Pb = Pb2+ + 2 e- (1)
2-es cella: Cu = Cu2+ + 2 e-
Pb2+ + 2 e- = Pb (1)
A cellákon áthaladó elektronok anyagmennyisége:
n(e-) = 350 / 96500 mol = 0,003627 mol (1)
Tömegnövekedések:
1-es cella:
Ag-elektród: Dm1=
0,003627107,9 g = 0,391 g. (1)
2-es cella:
Pb-elektród: Dm2 = (0,003627
/ 2).207,2g = 0,376 g. (1)
Összesen: 10 pont
5. feladat
Folyamatok:
C2H5OH + 3 O2 => 2 CO2 + 3 H2O(g) Qr1 = - 1236,2 kJ/mol (2)
H2O(f) => H2O(g) Qr2 = + 44,0 kJ/mol (1)
m(oldat) = x g 0, 500 x g C2H5OH; Q1 = - (0,500x / 46,0).1236,2 kJ
0,500 x g H2O; Q2 = + 0,500x / 18,0 . 44,0 kJ (2)
A teljes hőmennyiség:

Ebből: 12,215 x = 111,6
x = 9,138 (2)
a) Az elegy sűrűsége:
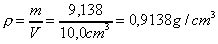
b) A 100,0 cm3 oldat összetétele:
m(oldat) = 91,38 g (1)
45,69 g etanol V(etanol) = 45,69 / 0,789 cm3 = 57,91 cm3
45,69 g víz V(víz)= 45,69 / 1,00 cm3 = 45,69 cm3(2)
Összesen: 11 pont
6. feladat
Vízben csak Na2O oldódik. (2)
Na2O + H2O = 2Na+ + 2OH- (1)
pH = 12,51-ből
[OH] = 0,03236 mol/dm3 (2)
A nátrium-oxid anyagmennyisége: n1 = 0,032360,4000,5
mol = 0,006472 mol
tömege: m1 0,40 g (66,67 tömeg%) (2)
Reakció sósavval:
MgO + 2 HCl = MgCl2 + H2O
Na2O + 2 HCl = 2 NaCl + H2O (1)
1,00 g keverékben
0,667 g azaz 0,01076 mol Na2O
és 0,333 g azaz 0,00826 mol MgO van. (2)
A szükséges sósav anyagmennyisége
n2 = (0,01076 + 0,00826)2 mol = 0,03804 mol (2)
térfogata
V2 = 0,03804/0,100 dm3
380 cm3.
(1)
Összesen: 13 pont
7. feladat
Anyagok:
| A | CH4 | E | CH3CHO |
| B | C2H2 | F | CH3COOH |
| C | H2 | G | CH3COCH3 |
| D | H2O |
(7)
Reakciók:
2 CH4 => C2H2 + 3 H2
C2H2 + H2O
CH3CHO
CH3CHO + CuO CH3COOH + Cu
2 CH3COOH
CH3COCH3 + CO2 + H2O (4)
Összesen: 11 pont
8. feladat
Összesen: 16 pont